Поэтому вдоль трека каждого
высокоэнергетического луча формируется стержень ионов, проходящий в живые
ткани. По этой причине рентгеновское и другие виды излучений называют
ионизирующим излучением.
Мутагенный эффект ионизирующей
радиации впервые был показан в нашей стране на микроорганизмах Г. А. Надсоном и
Г. С. Филипповым в 1925 г. Позднее он был
показан в США на дрозофиле Г. Д. Мёллером
(1890-1967), а затем и на многих других организмах. Этот эффект
вызывается повышенной реактивностью атомов, присутствующих в ДНК. Ионизирующие
излучения индуцируют генные мутации (транзиции, трансверсии, делеции,
включения), а также хромосомные разрывы, сопровождающиеся транслокациями и
другими аберрациями. В случае острого облучения погибает большинство сперматогоний,
но сперматоциты выживают, в результате чего в первые 6 недель после облучения происходит снижение фертильности, за
которым следует бесплодие (2—3 месяца).
Должна быть обеспечена защита в течение нескольких недель до и после зачатия.
Большую опасность представляет
рентгенодиагностика и рентгенотерапия брюшной полости и области таза. Поэтому
зачатие в течение нескольких недель до и после облучения должно быть исключено.
Для человека удваивающая доза
ионизирующего излучения по генным мутациям составляют 1 грей, по хромосомным аберрациям (транслокациям) — 0,15 грея. Характерной особенностью
ионизирующего излучения является также то, что для него отсутствует пороговость
в дозе, а так же то, что она обладает коммулятивным эффектом.
УФ-излучение характеризуется
меньшей энергией, проникает только через поверхностные слои клеток животных и
растений и не вызывает ионизации тканей. Обычно различают три вида
УФ-излу-чения, а именно:
а) УФ-излучение с длиной волны 180-290 нм. Это излучение не найдено в
солнечном свете, т. к. адсорбируется озоновым слоем. Оно продуцируется искусственно
бактерицидными лампами, используемыми для стерилизации.
б) УФ-излучение с длиной волны 290-320 нм. Это основная фракция солнечного
света. Она мутагенна.
в) УФ-излучение с длиной волны 320 нм. Оно также обладает повреждающим эффектом.
Мутагенные эффекты
УФ-излучения связаны с повышенной реактивностью атомов, присутствующих в
молекулах ДНК. Оно не опасно для половых клеток человека, поскольку поглощается
кожей, но опасно для последней, т. к. вызывает образование в клетках кожи тиминовых
димеров, мутагенный эффект которых заключается в том, что они вызывают мутации
не прямо, а нарушением точности репликации.
Химическими мутагенами
являются органические и неорганические кислоты, щелочи, перекиси, соли
металлов, этиленамины, формальдегид, фонолы, акридиновые красители,
алкилирующие соединения, аналоги пуриновых и пиримидиновых оснований и др.
Считают, что для действия химических мутагенов присуща пороговость. Одни
химические мутагены действуют как на реплициру-ющуюся, так и покоящуюся ДНК,
тогда как другие только на реп-лицирующуюся ДНК. Примером мутагенов, вызывающих
изменения и в реплицирующейся, и в покоящейся ДНК, являются алкилирующие
соединения (метилметансульфонат, этилметансуль-фонат и нитрозогуанидин) и
азотистая кислота. К мутагенам, действующим на реплицирующуюся ДНК, относят аналоги
азотистых оснований и акридиновые красители.
Многие химические мутагены
нарушают мейоз, что приводит к нерасхождению хромосом, а также вызывают разрывы
хромосом и генные мутации. Например, трипофлавин действует на все стадии
развития половых клеток, нитрозогуанидин —
перед мейозом, а тренинон — после мейоза.
Некоторые из химических
немутагенных соединений становятся мутагенами, попав в организм, как например,
циклофос4эамид.
Заслуживают внимания химические
вещества, используемые в качестве лекарственных соединений. Так после лечения
алкилирующими соединениями необходимо избегать зачатия в первые три месяца.
Известны сведения о мутагенности оральных (применяемых внутрь) химических
контрацептивов, которые получили очень большое распространение в последние
десятилетия, а также некоторых соединений, входящих в косметические средства и
в консерванты продуктов питания.
Биологическими мутагенами
являются вирусы, которые вызывают хромосомные аберрации в культивируемых
клетках. Такой способностью обладает, например, вирус гриппа. Транспозируемые
генетические элементы также способны вызывать генные и хромосомные мутации.
В экспериментальной работе
используют разные способы получения сайтонаправленных индуцированных мутаций,
т. е. мутаций, затрагивающих интересующие исследователя участки ДНК. В
частности, широко используют мутагенез in vitro клонируемой
ДНК, для этого последнюю обрабатывают нуклеазами (рестриктазами) или
химическими мутагенами. Кроме того, известны методы мута-генеза химически
синтезируемой ДНК. Наконец, возможно получение в стволовых эмбриональных
клетках экспериментальных животных хромосомных аберраций генноинженерным
методом.
Механизмы полиплоидии заключаются в том, что они являются результатом извращений одного или
более митотических делений клеток зародыша или результатом нерасхождения в
период мейоза всего набора хромосом, ведущего к образованию диплоидных гамет.
Нерасхождение хромосом у женщин имеет место в
80% случаев, а у мужчин оно наблюдается в
20% случаев, причем оно отмечается как в первом, так и во втором
мейотических делениях.
Механизмы гетероплоидии также связаны с нерасхождением хромосом. В частности
установлено, что, например, у человека три-сомии обеспечиваются нерасхождением
хромосом как в первом, так и во втором мейотическом делении.
Механизмы хромосомных
аберраций не совсем ясны. В любом случае они связаны с разрывами хромосом, как
у растений, так и у животных, что ведет к изменению последовательности
хромосомных генов.
Молекулярные механизмы генных
мутаций заключаются в изменениях последовательности азотистых оснований в
молекулах ДНК. Эти изменения происходят в результате замен, делеций
(выпадений), включений и дупликаций оснований, что ведет к изменению содержания
кодонов.
Изменения, связанные с заменой
оснований в молекулах ДНК, классифицируют на простые и перекрестные замены
(табл. 14).
Простые замены, или транзиции,
заключаются в замене одного пурина на другой пурин, и наоборот, в
двухцепочечной молекуле ДНК — пары А-Т на
пару Г-Ц, и наоборот. Транзиции осуществляются в процессе репликации ДНК без
изменения ориентации пар пурин-пиримидин в двухцепочечной молекуле ДНК, но при
этом происходят изменения в содержании кедонов.
Перекрестные замены, или
трансверсии, связаны с заменой в ДНК пурина на пиримидин, и наоборот.
Замещающий пиримидин спаривается с пурином, так что в двухцепочечной молекуле
ДНК вместо пары пурин-пиримидин оказывается пара пиримидин-пурин.
Следовательно, трансверсии приводят к новым ориентациям пар пурин—пиримидин и
заключаются в замене в двухцепочечной молекуле ДНК пары А-Т на пару Ц-Г, и
наоборот, пары А-Т на пару Т-А, и наоборот, пары Т-А на пару Г-Ц, и наоборот, а
также пары Г-Ц на пару Ц-Г, и наоборот.
Таблица 14
Типы замен оснований в молекулах ДНК
|
Исходное
основание
|
Основание, занявшее место исходного
|
Тип замены
|
|
Пурин
|
Другой пурин
|
Простая замена (транзиция)
|
|
Пиримидин
|
Другой пиримидин
|
То же
|
|
Пурин
|
Любой пиримидин
|
Перекрестная замена
(трансверсия)
|
|
Пиримидин
|
Любой пурин
|
Перекрестная замена
(трансверсия)
|
Спонтанные замены азотистых
оснований происходят очень редко. Например, в соответствии с существующими
расчетами у человека за год случается около
10—20 спонтанных замен оснований, причем одна замена может быть повторена
на каждые 10 000 генов лишь 50 раз на протяжении времени в 1 млн лет. Можно полагать, что такая
чрезвычайно низкая частота замен оснований в ДНК присуща как животным
(млекопитающим), так и растениям. Спонтанные замены азотистых оснований
возникают в ДНК в результате «ошибок», совершаемых ДНК-полимеразой и
сопровождающихся неправильным спариванием оснований. Одно из объяснений этой
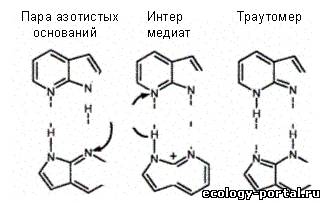
«ошибочности» было дано Д. Уотсоном и Ф. Криком еще в 1953 г. и оно сводится к признанию в ошибочном спаривании роли
тауто-мерных форм (структур, в которых протон перешел на место, противоположное
обычной водородной связи) естественных оснований. Следовательно, структурные
основы для мутаций в виде замен оснований обеспечивают таутомеры естественных
оснований.
Транзиции индуцируются азотистой кислотой, которая вызывает окислительное
дезаминирование аденина, цитозина и гуанина, содержащих свободные аминогруппы,
в гипоксантин, урацил и ксантин соответственно. Из-за того, что дезаминирование
сопровождается переходом аминооснования в кетонооснование, гипоксантин, например,
подобно гуанину, будет спариваться с цитози-ном, т. е. в результате дезаминирования
аденина в гипоксантин пара А-Т перейдет в пару Г-Ц. В случае дезаминирования
цитозина в урацил пара Г-Ц перейдет в пару А-Т. Транзиции индуцируются также
алкилирующими соединениями. Например, этилметан-сульфонат алкилирует гуанин и
освобождает от него ДНК без нарушения ее сахарофосфатного каркаса. Следовательно, гуанин
может быть заменен любым основанием, и это ведет не только к транзициям, но и к
трансверсиям.
Транзиции часто вызываются
мутагенами, действующими на ДНК только в состоянии репликации, например,
5-бромурацилом, который является аналогом тимина и способен включаться в ДНК посредством
замещения тимина. Наряду с нормальной способностью 5-бромурапила спариваться с
аденином иногда возникает состояние, когда он действует не как тимин, а как
цитозин, что обеспечивает формирование водородных связей его не с аденином, а с
гуанином. Эти «ошибки» спаривания происходят либо при включении 5-бро-мурацила
в ДНК («ошибки» включения), либо при репликации ДНК после его включения
(«ошибки» репликации). Следовательно, время «ошибок» определяет характер
транзиции. «Ошибки» спаривания, индуцируемые 5-бромурацилом, ведут к транзициям
от пары Г-Ц к паре А-Т, и наоборот (от А-Т к Г-П). Подобные транзиции индуцируются
также 2-аминопурином.
Замены оснований приводят к
изменениям смысла кодонов, вследствие чего они приобретают способность
кодировать другую аминокислоту (миссенс-мутации). Например, замена в триплете
ГУА, содержащемся в гене р-гемоглобина, урацила на аденин (трансверсия) сопровождается
тем, что в цепи р-гемоглобина вместо валина оказывается глутаминовая кислота.
Это ведет к превращению гемоглобина в новый вариант мутантного гемоглобина
(например, типа Бристоль). В результате замен оснований возникают также
нонсенс-мутации, когда на измененных кодонах обрывается чтение информации гена
(как правило, такими кодонами являются триплеты УАГ, УАА и УГА). Одновременно в
результате замен образуются кодоны, сохраняющие исходный смысл.
Делеции и включения одного или
нескольких азотистых оснований в нуклеотидных последовательностях ДНК могут
быть ошибками репликации ДНК или индуцироваться акридиновыми красителями. Такие
изменения называют мутациями сдвига рамки, ибо они приводят к сдвигу «рамки
чтения» кода гена. Включаясь между соседними основаниями, акридин оранжевый
заставляет их «раздвигаться» на расстояние в
0,6-0,8 нм.
Если акридин оранжевый
присутствует в полинуклеотидной цепи-шаблоне, то результатом будет добавление
основания в новую цепь в процессе репликации ДНК. Если же акридин оранжевый
присутствует в клетке во время репликации ДНК, то он может включаться в новую
цепь вместо основания, имитируя парное (противоположное) основание в
цепи-шаблоне, и затем выйти. Это приводит к тому, что вновь реплицированной
цепи будет недоставать основания, т. е. она будет реплицирована с делецией по
основанию- Делеции могут затрагивать несколько оснований. Например, описаны
делеции 15 оснований, которые сопровождались
утратой в белке 5 аминокислот.
Дупликации (добавление) 1—2 оснований могут приводить также к мутациям
со сдвигом «рамки считывания» кода. Если дупли-кация происходит внутри гена, то
«рамка считывания» нарушается на большом протяжении.
Делеции и дупликации азотистых
оснований представляют собой молекулярный механизм и мутации митохондриальной
ДНК человека. Установлено, что из мтДНК человека могут быть делегированы
сегменты длиной до 5000 пар оснований.
Особую форму молекулярных
механизмов генных мутаций представляют повторы триплетов азотистых оснований.
Наличие в молекулах ДНК повторов триплетов оснований сопровождается нарушениями
нормального цикла репликации ДНК, с одной стороны, и аномальным синтезом белка
(из-за повторов аминокислоты, кодируемой повторяющимся триплетом), с другой
стороны. Например, мутации гена, контролирующего белок хантингтан, недостаток
которого у человека сопровождается болезнью Хантингтона, заключаются в резком
увеличении повторов триплета ЦАГ.
| 




